第44章 热力学定律
§44-1 热机、第一定律
迄今为止,我们讨论物质性质都是从原子观点出发的,我们假定物质由遵从一定规律的原子所构成,企图由此来大致理解物质会出现什么情况。然而,物质性质之间的许多关系可以不考虑材料的具体结构而求得。不去过问物质的内部结构以确定物质各种性质之间的关系乃是热力学 的课题。历史上,在人们了解物质内部的结构之前,热力学就得到了发展。
举个例子说:由分子动理论我们知道气体的压强是由分子的碰撞引起的。我们还知道,如果加热气体,碰撞就会增加,压强也会增大。反之,如果一个气体容器上的活塞朝里移动以反抗碰撞的力,则碰撞在活塞上的分子能量将增大,结果温度也将上升。所以,一方面,如果在一定的体积下升高温度,压强就增大。另一方面,如果压缩气体,就会发现温度将上升。由分子动理论,人们可以得出这两种效应之间的定量关系,但是我们也许会本能地猜测它们之间是由某种与碰撞细节无关的必然方式联系起来的。
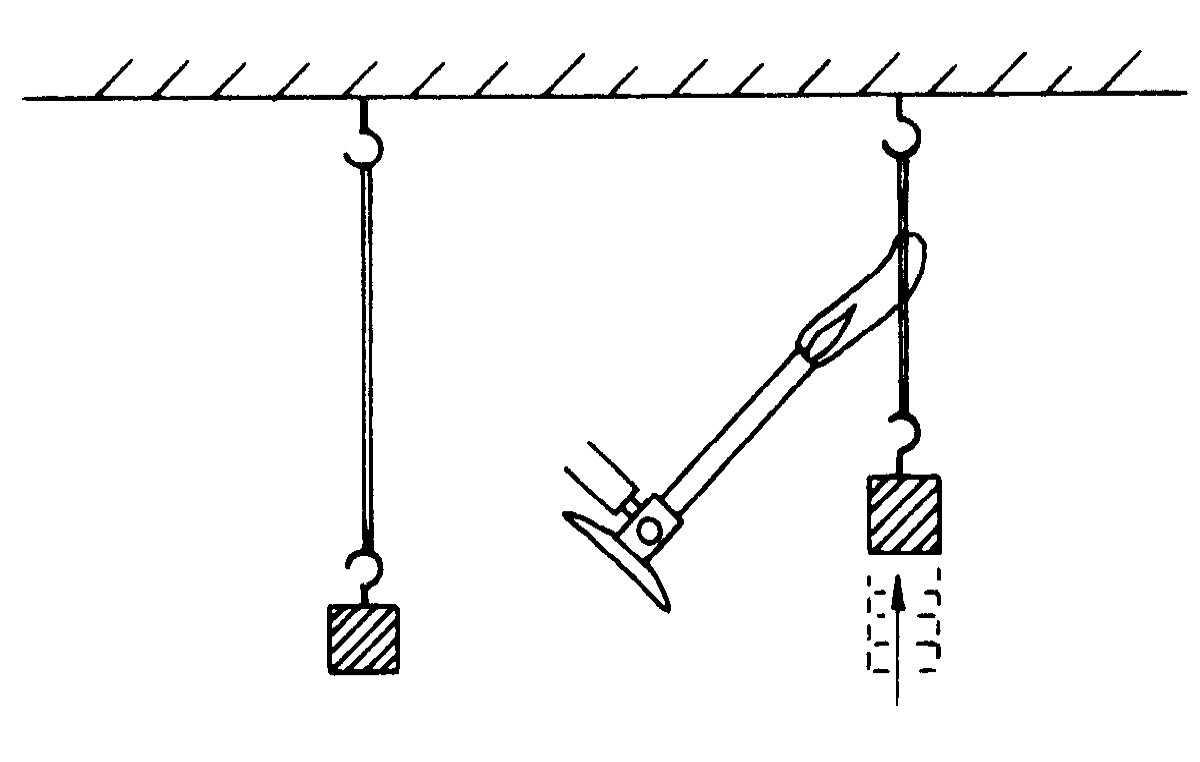
再考虑另一个例子。许多人都很熟悉橡皮的一个有趣性质:如果拉长一根橡皮带,它就会变热。例如,如果把橡皮带放在嘴唇间拉长它,你就会感到橡皮带明显地变热。这种变热是可逆的,也就是说,如果当橡皮带还在嘴唇间时很快地放松它,它就会明显地变冷,这意味着当我们拉紧橡皮带时,它会变热,而当我们放松橡皮带的张力时,它就会变冷。现在,我们的直觉告诉我们,如果加热橡皮带,它可能会拉紧:拉一根带子会使它变热的事实也许还意味着加热一根带子会使它收缩。事实上,如果我们用煤气灯加热一根悬挂着重物的橡皮带时,就会看到带子会骤然收缩(图44-1)。所以确实在加热橡皮带时它会拉紧这个事实与我们放松橡皮带的张力时它会变冷的事实之间有着一定的联系。
引起这些效应的橡皮带的内部机制是非常复杂的。我们将从分子的观点出发来作一些描写,虽然本章的主要目的是不涉及分子模型来理解这些效应之间的关系。不过我们可以从分子模型来说明这些效应是紧密联系的。理解橡皮带行为的一种方法是认为这种物质是由大量的长分子链(像一种分子“面条”那样)缠在一起而组成的。此外,它还具有另一种复杂性:分子链之间有着交键——就像有时一根面条穿过另一根面条时交叉在一起那样——那样的一种大的缠结。当我们拉开这样的缠结时,其中某些分子链趋向于沿着拉伸的方向排列。同时,链又处于热运动之中,所以互相之间又不停地碰撞。结果是,这样一根链如果被拉长的话,将不能自己保持这种状态,因为它将受到来自旁边的其他链和其他分子的碰撞,从而倾向于重新缠结在一起。所以,橡皮带具有收缩倾向的真实原因是,当把它拉开时,链变长了,而链旁边的分子的热扰动则趋向于使链重新缠结起来,使它变短。于是人们意识到,如果链保持伸长,而温度升高,使得链四周碰撞的活跃程度增加,链就趋向于收缩,因而在加热橡皮带时能拉起较大的重量。如果在拉伸了一段时间后,让橡皮带放松,那么每个链都变软,而碰撞到放松了的链上的分子在碰撞的时候损失了能量,于是温度就降低。
我们已经看到,加热时收缩与放松时变冷这两种过程可以由分子动理论联系起来,但是要从分子动理论确定这两者之间的精确关系,将是一个巨大的挑战。我们必须知道每秒发生多少次碰撞,这些链究竟像什么样子,同时还必须考虑到所有其他的复杂情况。细致的机制是这样复杂,以致我们实际上无法用分子动理论来精确确定所发生的事情。但是,我们可以得出所观察到的这两种效应间的明确关系,而毋须知道任何有关的内部机制。
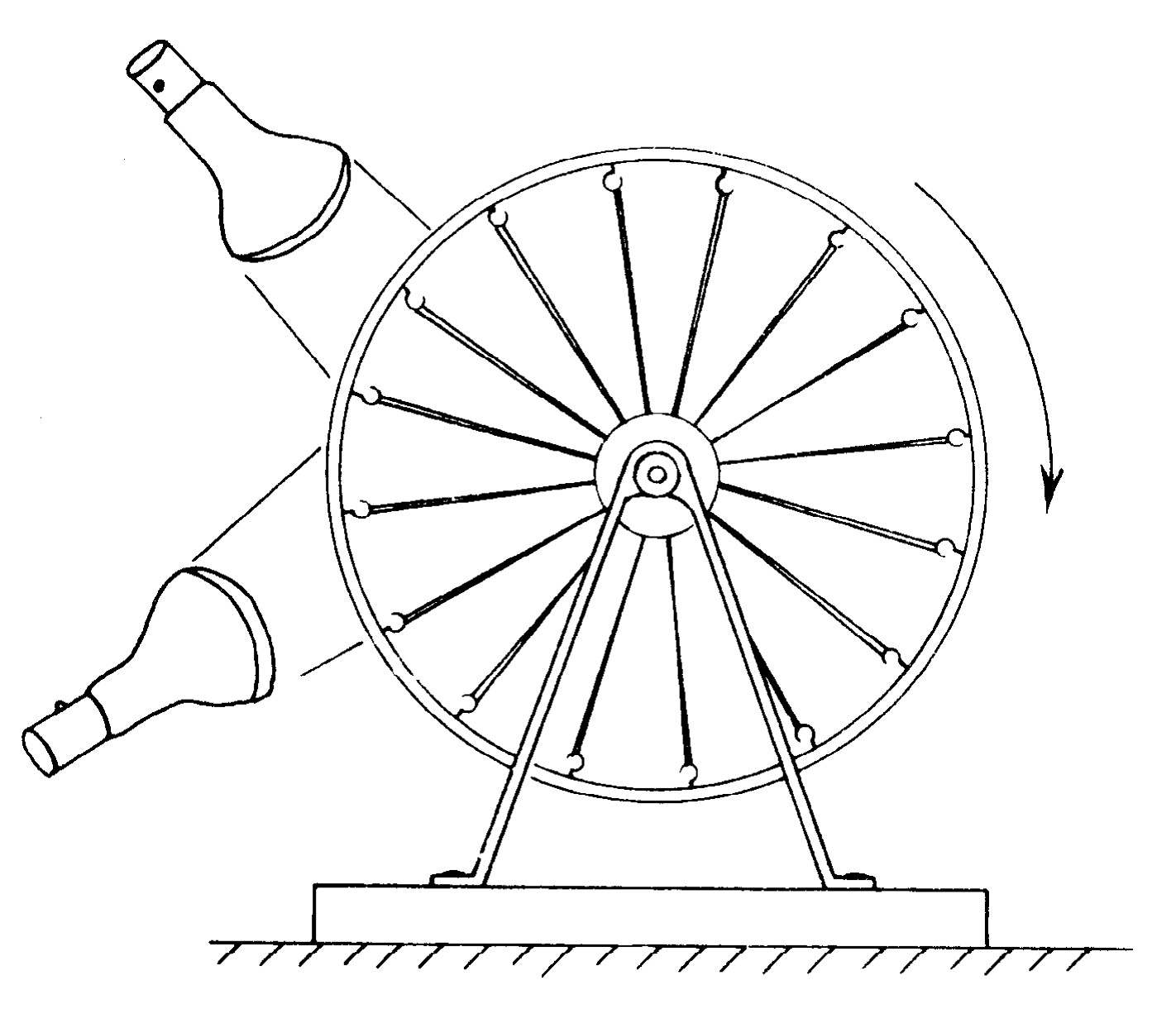
热力学整个课题从本质上说依赖于下面的这种考虑:因为橡皮带在高温时比在低温时更“强有力”,因此它应当有可能提起重物,移动重物,也就是说用热量做功。实际上,我们已从实验上看到受热的橡皮带能提起重物。研究利用热量来做功的方式是热力学这门科学的开端。我们能否制造出一台利用橡皮带的加热效应来做功的机器?我们可以制造一台外形不美观的机器来做这件事。它由一个自行车的轮子组成,轮子上的所有辐条都是橡皮带(图44-2)。如果我们在轮子的一边用一对加热灯泡来加热橡皮带,它们就比另一边的橡皮带更“强有力”。轮子的重心将偏离轴承中心而移到一边去,从而使轮子转动。当它转动时,冷的橡皮带向热的地方运动,已受热的橡皮带离开热的地方而变冷,所以在不断地加热时,轮子就一直缓慢地转动。这台机器的效率是非常低的。给两个灯泡提供400W的功率,这台机器才刚刚能提起一只苍蝇!然而,一个有趣的问题是,我们能否用更有效的方式来利用热量做功?
事实上,热力学这门科学就是起源于伟大的工程师卡诺对如何制造最好的和最有效的热机这个问题所作的分析,这是工程学对物理理论作出基本贡献的少数几个著名的例子之一。可以想到的另一个例子是香农所作的信息论的最近的分析。顺便提一下,这两种分析之间有着密切的联系。
一台蒸汽机通常的工作方式是先用锅炉烧开一些水,所产生的蒸汽膨胀推动活塞而使飞轮转动。这样,蒸汽就推动了活塞——以后怎么办呢?我们必须做完的事是:完成一个循环,一个笨拙的方法是让蒸汽放到空气中去,于是就要不断地加水。比较便宜也比较有效的方法是把蒸汽放到另一个箱子里,在那里用冷水使它凝结,然后再把这些水抽回到锅炉里去,这样就能连续地循环往复工作。于是蒸汽机不断得到热量并把它们转变为功。现在我们要问,利用酒精是不是会更好一些呢?为了得到一台最好的热机,物质应当具有怎样的性质?这就是卡诺向自己提出的问题,而其中的副产品之一就是发现了我们上面刚刚解释过的这种类型的关系。
热力学的结果全都包括在一些称为热力学定律 的十分简单明了的命题里。在卡诺那个时代,人们还不知道热力学第一定律——能量守恒定律,然而卡诺的论证作得很仔细,以致虽然当时还不知道第一定律,但这些论证仍然成立!若干年后,克劳修斯(Clausius)作了一个比较简单的推导,它比起卡诺的非常精巧的推理来更易理解。结果表明,克劳修斯假设的不是一般的能量守恒定律,而是按照热质说认为热量 是守恒的。后来知道,热质说是错误的,所以人们时常说卡诺的逻辑是错误的。但他的逻辑是完全正确的。只有克劳修斯的简化的论证人人都看得出是不正确的。
所谓热力学第二定律是卡诺在热力学第一定律之前发现的!给出卡诺不使用第一定律来作出的论证是有趣的,但是,我们不这样做,因为我们要学的是物理而不是历史。我们从开始就运用热力学第一定律,尽管许多事情没有它也能作出。
我们首先陈述第一定律,即能量守恒定律:如果对一个系统加热,并对它做功,那么它的能量将由于吸收热量和对它所做的功而增加。这可以表示为:加进系统的热量Q ,加上对系统所做的功W ,等于系统的能量U 的增加;能量U 有时称为内能。于是
能量U 的变化=Q +W .(44.1)
能量U 的变化可以通过热量微元ΔQ 与功微元ΔW 相加来表示
ΔU =ΔQ +ΔW .(44.2)
这是同一条定律的微分形式。关于这一点,在早先的一章中我们已知道得很清楚。
§44-2 第二定律
现在要问热力学第二定律是什么?我们知道,如果反抗摩擦力做功,那么所损耗的功就等于所产生的热量。如果我们在温度为T 的室内足够缓慢地做功,室温不会改变得很大,那么我们是在给定的温度下将功转变为热。是否可能存在逆过程?是否有可能在给定的温度下反过来将热转变为功?热力学第二定律断言这是不可能的。假定能够只通过把像摩擦这样的过程反过来就能使热转变为功,这就太方便了。如果我们只从能量守恒来考虑,我们可以想象把热能(比如在分子振动中的能量)作为提供有用能量的良好来源。但是卡诺认为,不可能在单一温度下取出热能。换句话说,如果整个世界处于同一温度下,那么我们就不可能将任何热能转变为功:在一个给定的温度下,使功转变为热的过程是可以发生的,但不能把它反过来再得到这些功。说得更具体一些,卡诺认为:不可能在一个给定的温度下取出热量,并把它转变为功而不引起系统或周围环境的其他任何变化 。
最后一句话是非常重要的。假设有一罐处在某给定温度下的压缩空气,我们让空气膨胀。这时它就能做功,比如说,可以使锤子移动。在膨胀中气体会稍稍变冷,但是如果在一个给定温度下,我们有一个像海洋那样的热库,那么就可以使空气再变热。这样就从海洋中取出了热量,并利用压缩空气做功。但是,卡诺并没有错,因为我们没有使每件事情保持原样 。如果我们重新压缩已经膨胀的空气,就会发现我们做了额外的功,在完成这一切后我们发现,不仅没有从温度为T 的系统内取出功,实际上反而对它做功。我们讲的必须只是这样一种状况,其中整个过程的净结果 是取出热量,并把它转变为功,正如反抗摩擦力做功这个过程的净结果是取出功,并把它转变为热那样。如果系统循环运动,我们可以使系统严格回到它的出发点,产生的净结果是反抗摩擦力做功,并产生热量。能把这个过程反过来吗?能否按一下开关,使每样东西都反过来进行,从而使摩擦力反抗我们做功,而海洋就冷却下来呢?卡诺的回答是:不行!所以我们也假定这是不可能的。
假定这种情况可能出现,那就意味着,我们可以不花任何代价而从一个冷的物体中取出热量,并把它放进一个热的物体中去。我们知道一个热的东西能使一个冷的东西变热,这是很自然的。我们的实验还证实,如果只是简单地把热的物体与冷的物体放在一起,而其他一切都保持不变的话,那么绝不会发生热的物体越来越热,冷的物体越来越冷的情况!但是如果我们能从比如说海洋中,或从任何在单一温度下的其他东西中取出热量来做功的话,这个功就可以在某个其他温度下反过来通过摩擦而转变成热。例如,一台正在工作的机器的某工作臂可以和某种已经变热的东西发生摩擦。净结果是从一个“冷”的物体,即海洋中取出热量来,并把它放进一个热的物体里去。现在,按照卡诺的假定有时也把热力学第二定律表述如下:热量不能自动地从冷的物体流到热的物体。正如我们刚才看到的,这两个命题是等价的:第一个命题说,人们不可能设计这样一种过程,它的唯一结果是在一个单一的温度下将热转变为功,第二个命题说,人们不可能使热量自动地从冷的地方流到热的地方。我们主要采用第一种形式。
卡诺对热机的分析十分类似于第4章讨论能量守恒时我们对于起重机械问题所作的论证。事实上,那个论证正是仿效卡诺对热机的论证,所以现在的处理看起来非常相似。
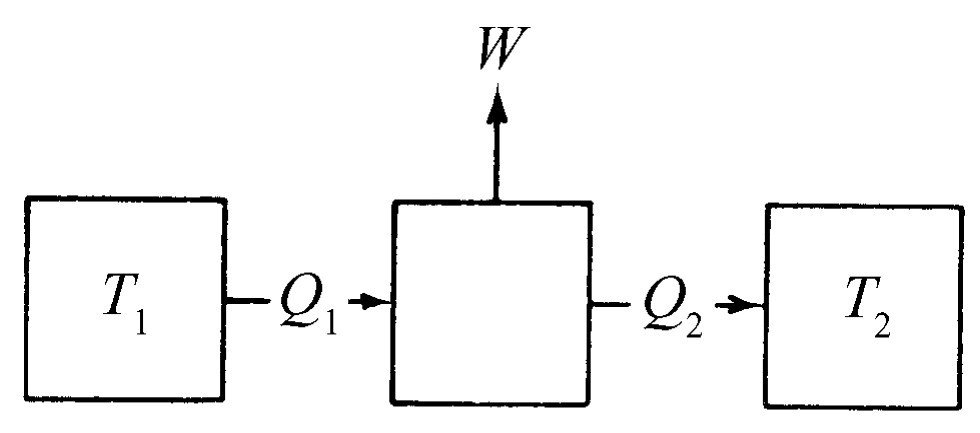
假设我们建造了一台带有某个温度为T 1 的“锅炉”的热机。从锅炉中取出了一定的热量Q 1 ,蒸汽机做了某些功W ,放出一些热量Q 2 给另一个温度为T 2 的“冷凝器”(图44-3)。由于卡诺不知道热力学第一定律,所以他不说热量是多少,也不用Q 2 等于Q 1 这条规则,因为他不相信这一点。虽然根据热质说,每个人都会认为Q 1 与Q 2 必定相等。卡诺则不说它们是相等的——这就是他的论证中的部分高明之处。如果利用热力学第一定律,就会发现放出的热量Q 2 等于吸收的热量Q 1 减去所做的功
Q 2 =Q 1 -W .(44.3)
(假设有某种循环过程:在凝结后又把水泵回到锅炉中去,我们将说,在每一循环中,对进行循环过程的一定量的水来说,吸收了热量Q 1 ,并做了功W )。
现在我们将建造另一台热机,看看若用在温度T 1 下放出的同样的热量,以及温度仍为T 2 的冷凝器,能否做更多的功。我们将利用从锅炉中得到的同样多的热量Q 1 ,并试图用别的液体,如酒精,以得到比在蒸汽机的情况下更多的功。
§44-3 可逆机
现在必须对我们的热机进行分析。有一件事很清楚:如果热机中含有存在着摩擦的装置,那么就有损耗。最好的热机是无摩擦的热机。于是,我们作一个和在研究能量守恒时作过的同样理想化的假设,即假设一个理想的无摩擦的热机(图44-3)。
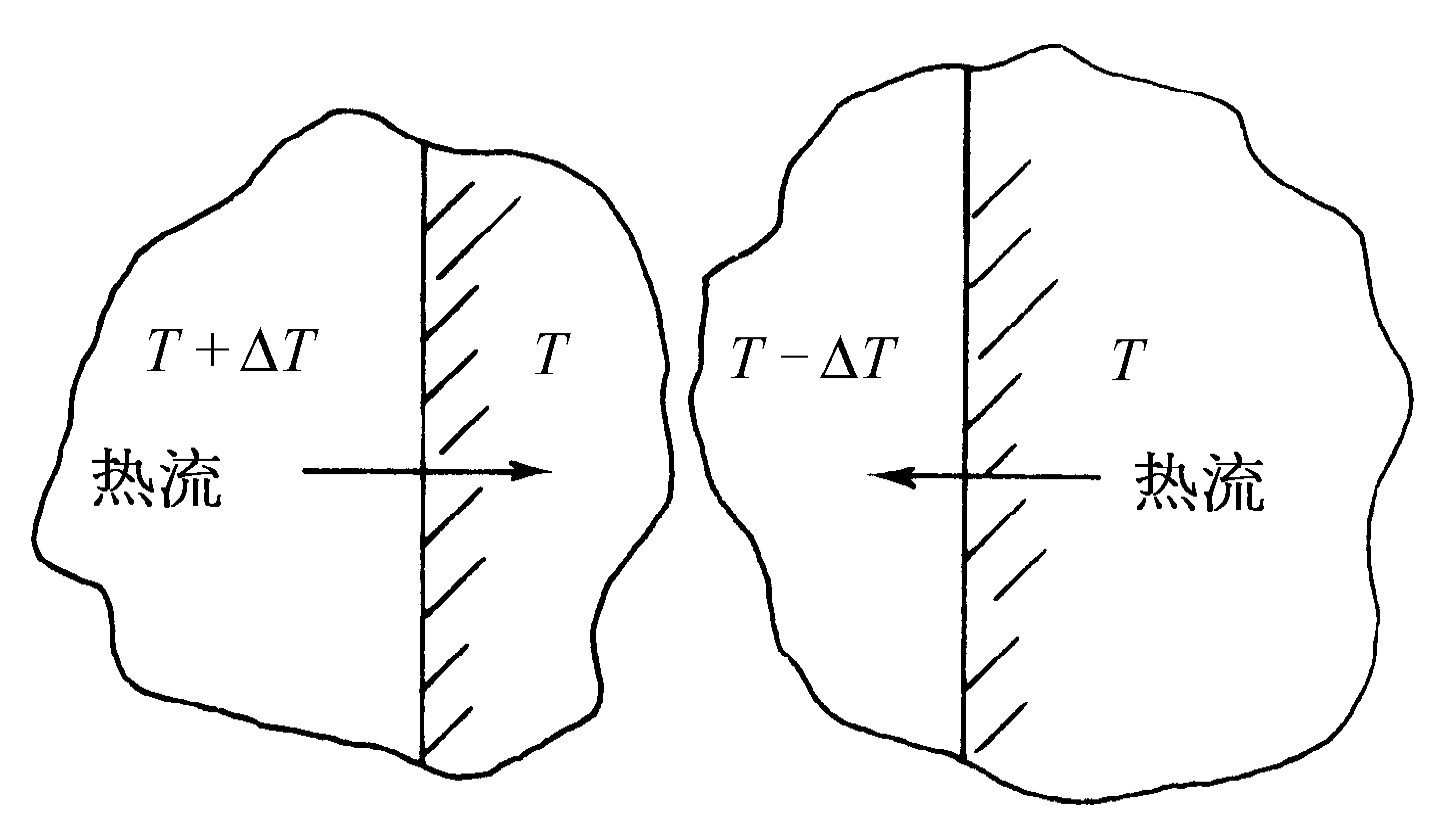
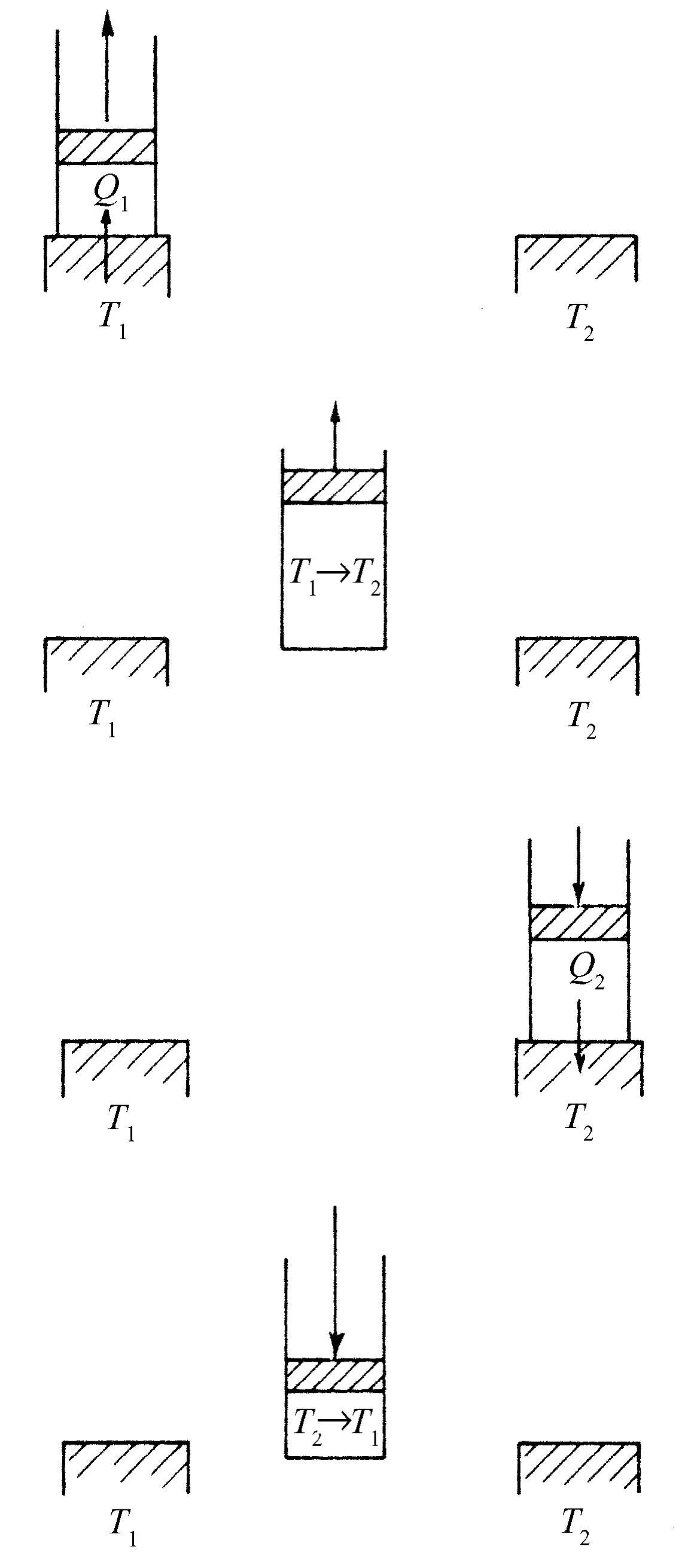
我们还必须考虑与无摩擦运动相类似的情况,即“无摩擦”的热传递。把一个温度高的热物体放在一个冷物体上,于是有热流产生,这时不可能通过让每个物体的温度作非常微小的变化来使热量沿相反方向流动。但是,当我们有一台实际上没有摩擦的机器时,如果用一个小小的力沿一个方向推它,它就沿这个方向运动,如果用一个小小的力沿另一个方向推它,它就沿另一个方向运动。我们需要找出与无摩擦运动类似的情形:只利用微小的变化就能把热量传输的方向反过来。如果温度差有限,那么这是不可能的,但是如果我们能够确信热量流动总是在温度基本相同的两个物体之间发生,只要两个物体具有无限小的差别就可使热量顺着我们所希望的方向流动,这种流动称为可逆的(图44-4)。如果我们在左边稍微加热物体,热量将流向右边;如果我们使左边稍微冷却,热量将向左边流动。这样我们就发现理想热机就是所谓可逆 机,其中的每一个过程在这种意义下都是可逆的,即只作极小的、无限小的变化,我们就能使热机沿相反方向运行。这意味着在机器中的任何地方都必然不存在可觉察到的摩擦力,并且也肯定没有发生热库或锅炉火焰直接和某种确定地较冷或较热的东西相接触。
现在考虑一台所有过程都可逆的理想热机。为了说明这一种东西在原则上是可能的,我们将举一个热机循环的例子,它可能是也可能不是实际的,但至少在卡诺设想的含义上是可逆的。如图44-5所示,假设有一个盛有气体的汽缸,汽缸上带有一个无摩擦的活塞。气体不一定必须是理想气体,甚至液体也不一定必须能汽化,但是为了确定起见,我们认为这是一种理想气体。假设我们还有两个很大的热垫T 1 和T 2 ——一种具有确定温度T 1 和T 2 的很大的东西。假定现在的情况是T 1 高于T 2 。我们先加热气体,同时让它膨胀,这时它与热垫T 1 接触。在这样做的时候,一旦热量流入气体,活塞就非常缓慢地被顶出,我们确信气体的温度永远不会远离T 1 。假定活塞被顶得太快,气体的温度就会比T 1 低许多,于是过程就不完全是可逆的,但若活塞被顶得足够慢,气体的温度就永远不会远离T 1 。另一方面,如果我们缓慢地把活塞推回来,气体温度只比T 1 高一个无限小量,热量将传回给热垫。我们看到,这样一种进行得足够缓慢的等温(温度不变)膨胀是可逆过程。
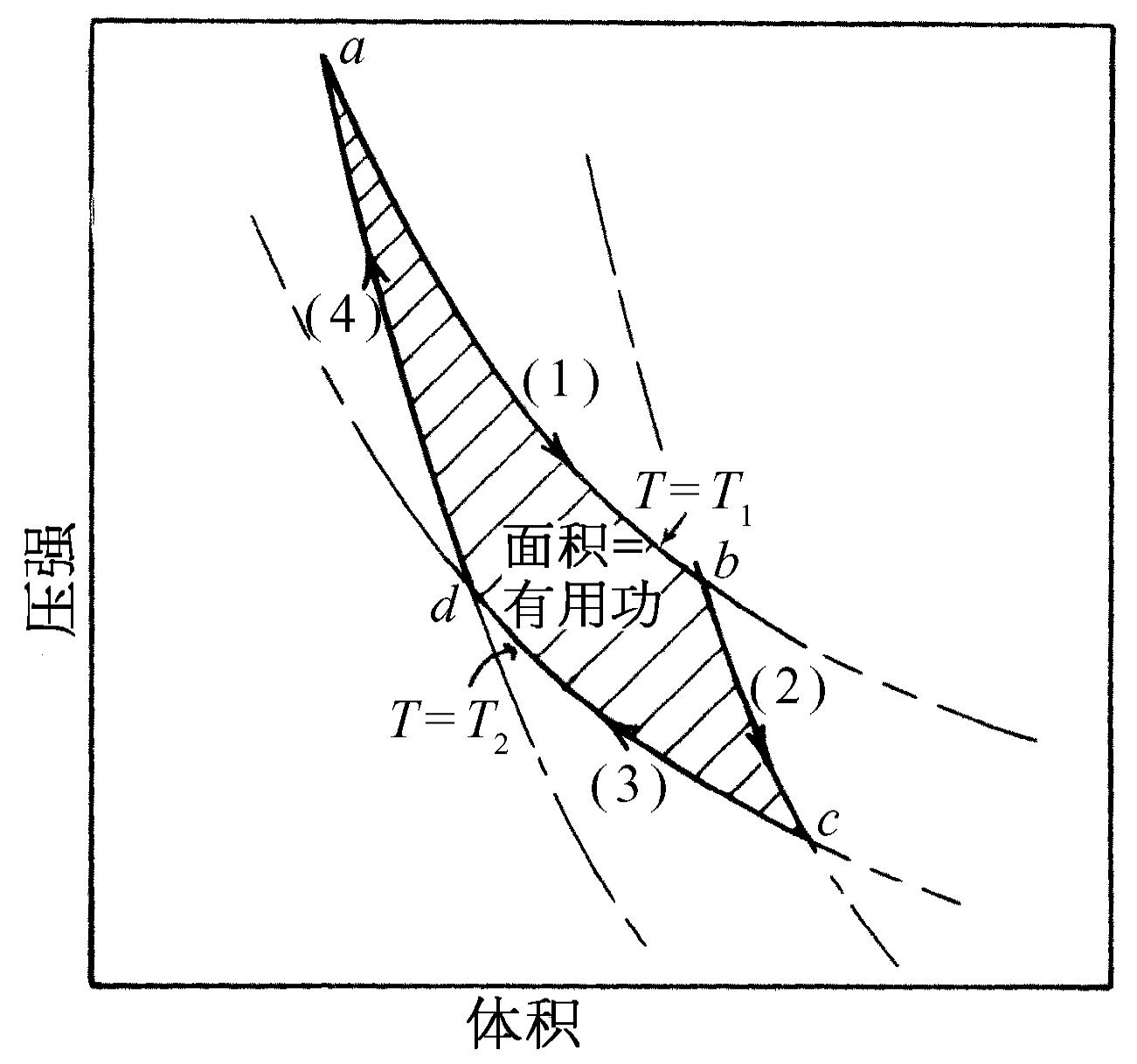
为了理解刚才所做的事,我们画出气体压强与体积之间的关系图(图44-6)。当气体膨胀时,压强下降。记为(1)的曲线告诉我们当温度固定为T 1 时,压强随体积会如何变化。对于理想气体来说,这条曲线就是PV =NkT 1 。在等温膨胀中,当体积增加时,压强降低,直到停在b 点为止。同时,必然有一定的热量Q 1 从热库流入气体,因为我们已知,如果气体膨胀时不与热库接触,它就会冷却。完成了等温膨胀而停止在b 点后,我们将汽缸从热库拿开,并让它继续膨胀。这时我们不让任何热量进入汽缸,同时仍让气体缓慢地膨胀,再假设没有任何摩擦力,因此没有任何理由说这个过程不可逆。气体继续膨胀时,因为再没有任何热量进入汽缸,所以气体温度将下降。
令气体沿着记为(2)的曲线膨胀,直到温度降为T 2 到达c 点。我们把这种不加进热量的膨胀称为绝热 膨胀。对于理想气体来说,我们已知曲线(2)具有PV γ =常数的形式,这里γ 是大于1的常数,所以和等温曲线相比,绝热曲线具有更负的斜率。现在汽缸的温度达到T 2 ,因而如果我们把它放在温度为T 2 的热垫上,将不会出现不可逆的变化。现在在气体与温度为T 2 的热库接触的情况下,沿着记为(3)的曲线缓慢地压缩气体(图44-5,第二步)。因为汽缸与热库接触,它的温度不会升高,但是热量Q 2 要在温度为T 2 时从汽缸流入热库。在沿曲线(3)等温地压缩气体至d 点后,我们把汽缸从温度为T 2 的热垫上拿开,并继续压缩气体,同时不让任何热量流出。于是气体的温度将上升,压强将沿记为(4)的曲线变化。如果妥善地实现每一步骤,我们可以回到温度为T 1 的起点a 处,并且重复这一个循环。
在图44-6上可以看到,我们已经使气体作一个完整的循环,在这一循环中,我们在温度T 1 处加进了热量Q 1 ,而在温度T 2 处取走了热量Q 2 。现在,要点在于这个循环是可逆的,因而我们能够把所有的步骤用另外反过来的方式表示。我们可以反向循环而不是正向循环:让气体从温度为T 1 的a 点出发,沿曲线(4)膨胀,膨胀到温度T 2 后再吸收热量Q 2 ,等等,使循环反向进行。如果我们沿这个方向作一个循环,我们必须对气体做功;而如果我们沿相反的方向循环,气体必定对我们做功。
附带提一下,不难求出功的总量,因为在任何膨胀过程中所做的功是压强乘以体积的变化,即∫P dV 。在这个特殊的循环图中,垂直轴表示P ,水平轴表示V 。如果我们称垂直坐标为y ,水平坐标为x ,功就是∫y dx ——换句话说,就是曲线下的面积。因此每条曲线下的面积就是对应的那个步骤中对气体或由气体所做的功。不难看出所做的净功就是图中的阴影面积。
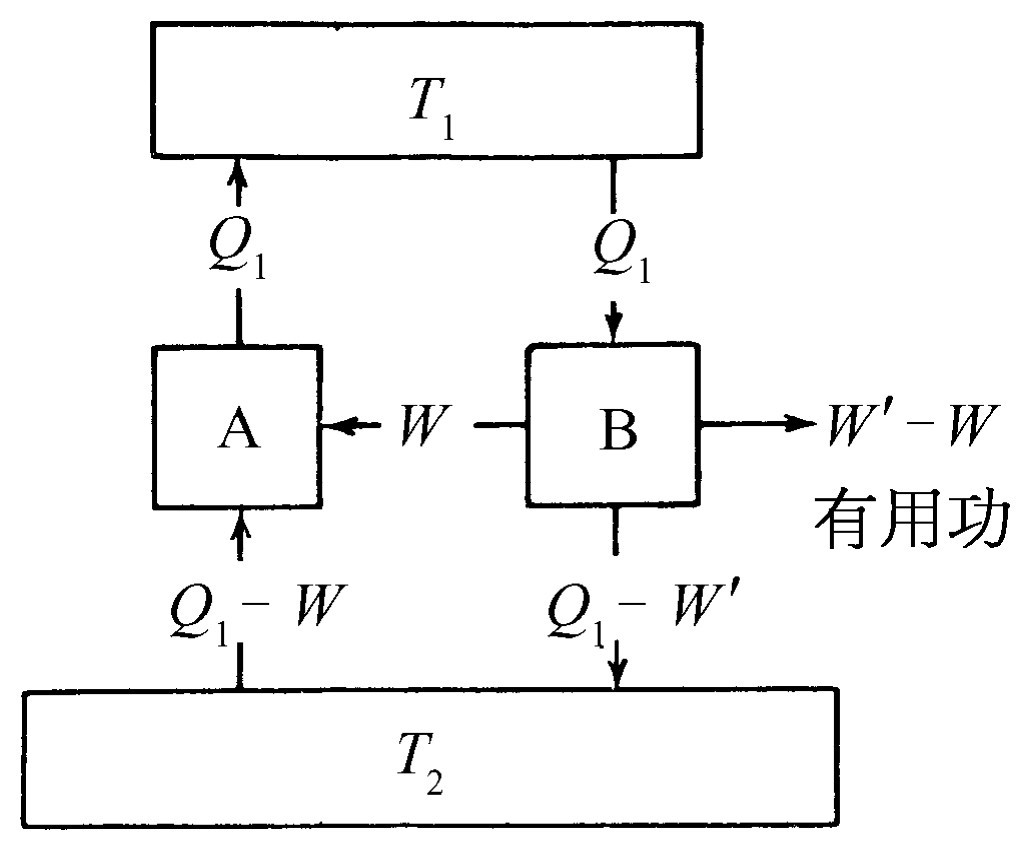
现在我们已经举了一个可逆机的简单例子。我们还将假定可能有其他这样的热机。设有某个可逆机A,它在T 1 温度下吸收热量Q 1 ,做了功W ,并且在T 2 温度下释放了部分热量。现在我们假设还有另一台热机B,它或许已经设计成功,或许还没有发明出来。这台热机由许多橡皮带、蒸汽或别的什么东西制成,既可以是可逆的,也可以是不可逆的,但要设计得使它在温度T 1 下吸收同样多的热量Q 1 ,而在较低的温度T 2 下释放出热量(图44-7)。假设热机B做了一定的功W′ 。现在我们将要证明,W′ 不会大于W ,也就是说没有一台热机做的功能够超过可逆机。为什么?假设W′ 确实大于W ,那么我们可以从T 1 热库中取出热量Q 1 ,利用热机B可以做功W′ ,并且释放一些热量到T 2 热库中去,至于究竟有多少我们不去管它。这样做以后,由于已经假设W′ 大于W ,我们可以省下W′ 中的某些功,利用它的一部分功W 而使其余的功W′ -W 作为有用功。利用功W 可使热机A反过来运转,因为它是一个可逆机 。它将从T 2 热库中吸收某些热量,并把热量Q 1 放回给T 1 热库。经过两重循环后,净结果就是每样东西都回到原来的状态,但可以做某些额外的功,即W ′-W ,而我们所做的一切 就是从T 2 热库中取出能量!我们已经很小心地把热量Q 1 还给了T 1 热库,因而这个热库可以很小,也可以把它放在联合热机(A+B)“之内”,这个联合热机的净结果是由T 2 热库取出净热量(W ′-W ),并把它变为功。但是,按照卡诺的假设,要从某个单一温度下的热库中取得有用功而不发生任何其他变化 是不可能的,它是无法实现的。因此,在相同温度的运行条件下,没有一台热机能从较高温度T 1 吸收一定的热量,又在T 2 温度下释放一些热量,而所做的功能大于可逆机。
现在假设B机也是可逆的。当然,这时不但必须满足W′ 不大于W ,也可以把论证反过来证明W 也不能大于W′ 。所以,如果两台热机都可逆,它们必定做同样大小的功,这样,我们就得到了卡诺的光辉结论:如果一台热机是可逆的,那么不管它是怎样设计的,都不会有任何不同,因为如果这台热机在温度T 1 下吸收一定的热量,而在某个其他温度T 2 下释放一些热量,人们所得到的功与热机的设计无关 。这是自然界的属性,而不是个别热机的特性。
如果我们能够找出一条定律来确定在温度T 1 下吸收热量Q 1 和在温度T 2 下释放一些热量时能够做多少功,那么这个量将具有普遍的性质,而与物质无关。当然,如果我们知道了某种特殊物质的性质,并且能把这个量求出,就能够说,在一台可逆机中工作的所有其他物质也必定给出同样大小的功。这是一个关键的想法,利用这条线索,我们可以求出,比方说,当加热橡皮带时它收缩的程度与放松橡皮带时它冷却的程度之间的关系。我们不妨设想把这样的橡皮带放进一台可逆机中,并使它经过一个可逆循环。净结果(即做功的总量)是一个普适函数,亦即一个与物质无关的函数。所以我们看到物质的性质必然有一定的限制。人们不能要求任何想要的东西,也不可能发明一种物质,使这种物质经过一个可逆循环后,得出比所允许的最大值还大的功。这条原则和这种局限性是热力学得出的唯一真实的规则。
§44-4 理想热机的效率
现在来找出决定功W 作为Q 1 、T 1 和T 2 的函数的定律。显然W 正比于Q 1 ,因为如果我们考虑两个并联的可逆机时,这两台一起工作的热机组合起来仍然是可逆机。假设每台热机都吸收热量Q 1 ,那么两台热机合在一起吸收热量2Q 1 ,所做的总功就是2W ,等等。所以W 正比于Q 1 是合理的。
现在,下一个重要步骤是找出这条普适定律。如果研究一台用我们已经知道它的规律的特定物质(例如理想气体)制成的可逆机,我们就能够而且一定找得出这个定律。通过纯粹的逻辑论证,根本不用任何特殊的物质也能得出这条规律。这是物理学中最出色的理论证明之一,如果不把它证明给你们看,就会于心不安,所以对于那些希望知道证明的人来说,我们将在适当时候讨论它。但是我们先用理想气体进行直接计算,这是一种不太抽象的、较为简单的方法。
我们只要得到Q 1 和Q 2 的公式(因为W 刚好等于Q 1 -Q 2 ),即在等温膨胀或压缩的过程中和热库交换的热量的公式。例如,从压强为p a ,体积为V a ,温度为T 1 的a 点[图44-6中标记为(1)的曲线],等温膨胀至压强为p b ,体积为Vb ,温度仍为T 1 的b 点时,将要从温度为T 1 的热库中吸收多少热量Q 1 ?对于理想气体来说,每个分子具有一个只取决于温度的能量,而且因为a 点和b 点的温度和分子数相同,内能也就相同。内能U 没有任何变化 。气体在膨胀过程中所做的总功
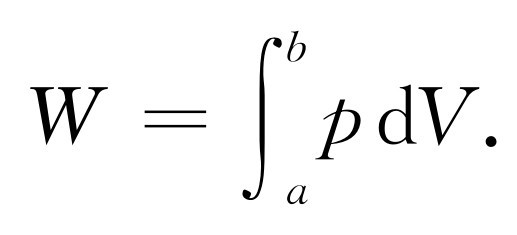
它等于由热库取出的能量Q 1 。在膨胀过程中,pV =NkT 1 ,或
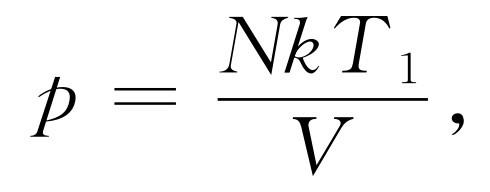
于是
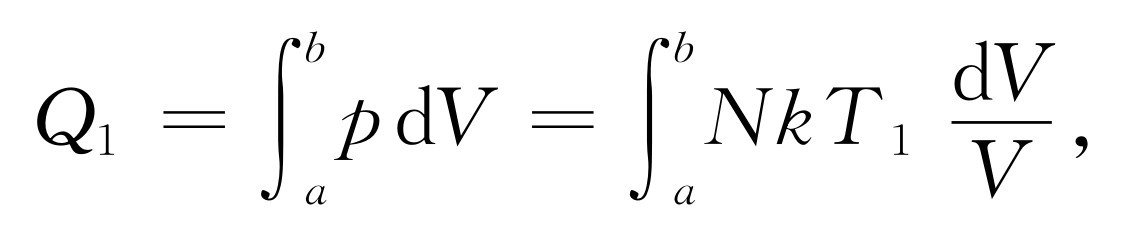 (44.4)
(44.4)
即
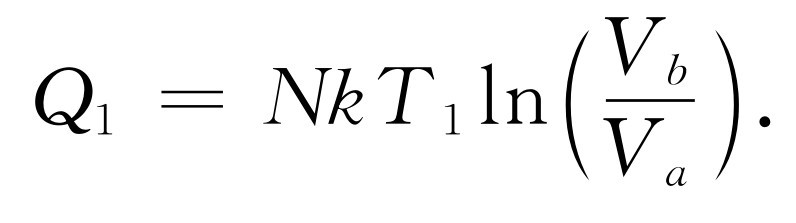
这就是从T 1 热库取得的热量。同样,对于在T 2 温度下的压缩来说[图44-6曲线(3)],释放给T 2 热库的热量是
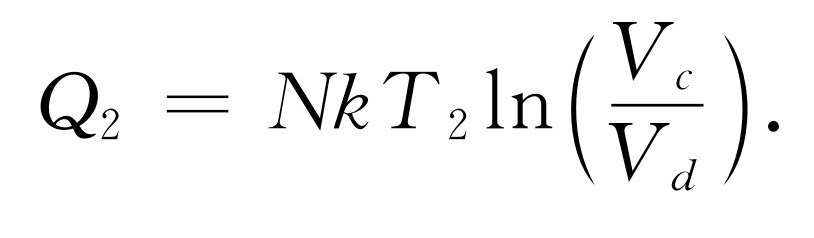 (44.5)
(44.5)
为了完成我们的分析,只要求出V c /V d 与V b /V a 之间的关系。注意到曲线(2)是从b 到c 的绝热膨胀,在这个过程中pV γ 是一个常数,就可以找出这个关系。因为pV =NkT ,可以把它写为(pV )V γ- 1 =常数,或者,利用T 和V ,可写为TV γ- 1 =常数,即
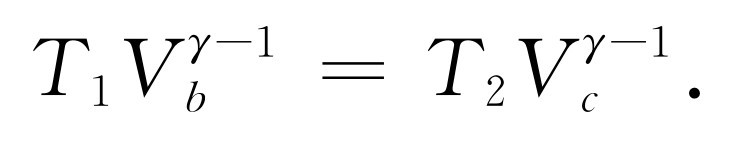 (44.6)
(44.6)
类似地,由于曲线(4),从d 到a 的压缩也是绝热的,我们有
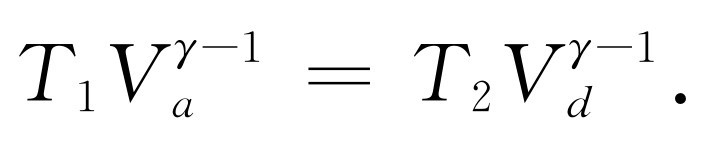 (44.6a)
(44.6a)
式(44.6)除以式(44.6a)后,可得V b /V a 必定等于V c /V d ,所以式(44.4)与式(44.5)中的对数项相等,于是便有
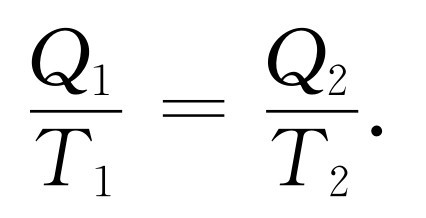 (44.7)
(44.7)
这就是我们要找的关系。虽然这是对理想气体热机所作的证明,但我们知道对于任何可逆机 它都必定完全成立。
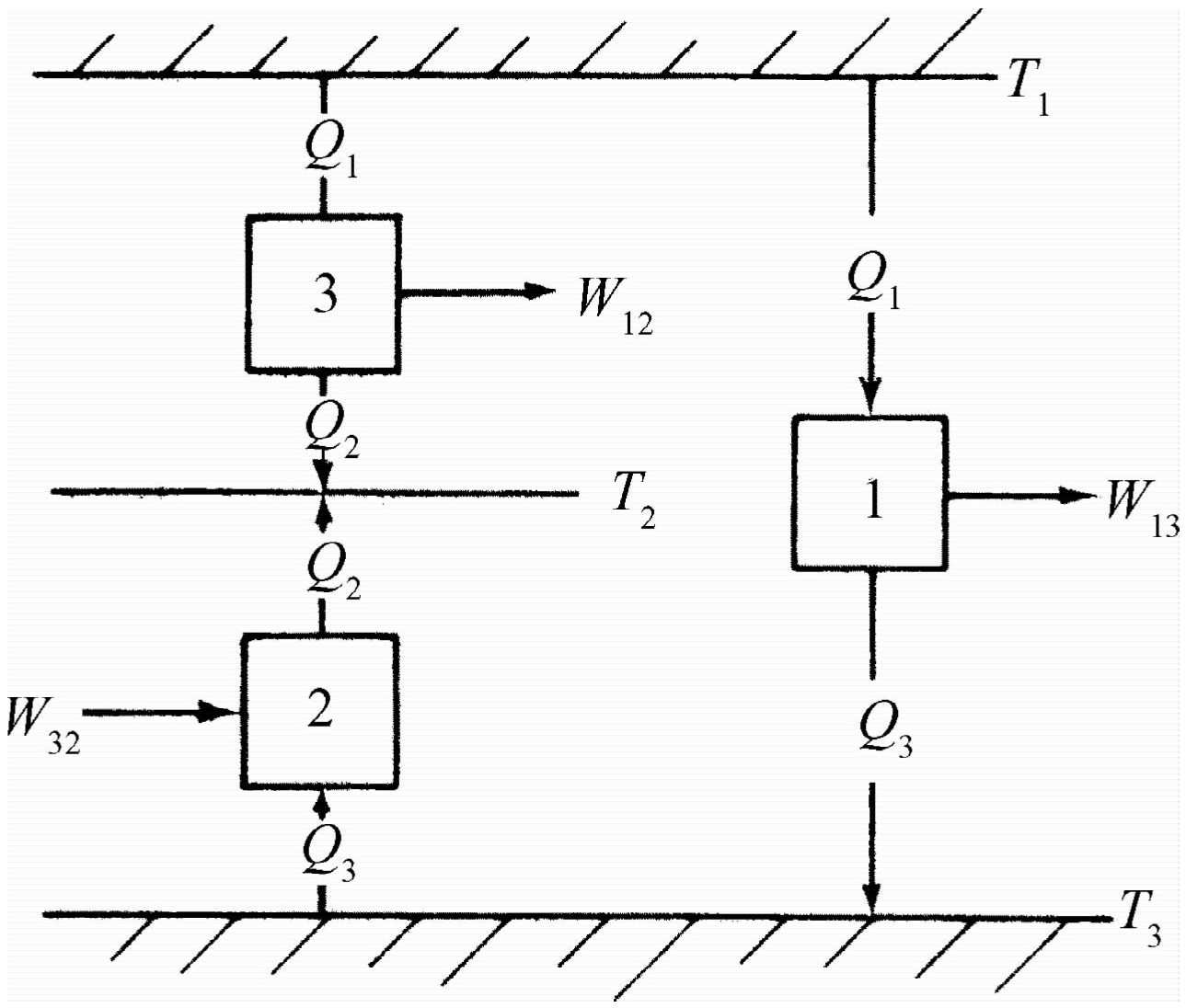
现在我们来看看如何能通过逻辑推理求得这条普适的定律,而无需知道任何特殊物质的性质。现推导如下:假定有三个热机和三种温度T 1 、T 2 和T 3 。令一台热机在T 1 温度下吸收热量Q 1 ,做功W 13 ,并在温度T 3 下放出热量Q 3 (图44-8)。令另一台热机在T 2 和T 3 之间反过来运转。再假定把第二台热机设计得正好吸收同样的热量Q 3 ,放出热量Q 2 。我们必须对它做一定的功W 32 ,这里W 32 是负的,因为这台热机反过来运转。当第一台热机经过一个循环后,它吸收热量Q 1 而在温度T 3 下放出热量Q 3 ,然后第二台热机从T 3 热库取出同样的热量Q 3 ,而将热量Q 2 释放给温度为T 2 的热库。因此这两台热机一前一后地运行的净结果是从T 1 吸收热量Q 1 ,而在T 2 放出热量Q 2 。于是这两台热机等价于第三台热机,第三台热机是在T 1 下吸收热量Q 1 ,做功W 12 ,然后在T 2 下放出热量Q 2 。因为由热力学第一定律我们立刻可以证明W 12 =W 13 -W 32
W 13 -W 32 =(Q 1 -Q 3 )-(Q 2 -Q 3 )=Q 1 -Q 2 =W 12 ,(44.8)
于是我们可以得到关于热机效率的定律,因为在温度T 1 和T 3 之间,T 2 和T 3 之间,以及T 1 和T 2 之间运行的热机效率之间显然必定存在某种联系。
我们可以用下述方式使论证更为清楚:刚才已经看到,我们总可以通过找出在某个其他温度T 3 下释放的热量,而把在T 1 吸收的热量和在T 2 释放的热量联系起来。如果引进一个标准温度,用这个标准温度来分析每一样东西,我们就能求得所有的热机的性能。换句话说,如果我们知道一台运转在一定的温度T 和某个确定的标准温度间的热机效率,就可以求出在任何其他温度差下的热机效率。因为我们假定只用可逆机,我们可以使它从初始温度下降到标准温度,然后再回升到最终温度。我们将标准温度任意定义为1° ,并用一个特殊记号Q s 来表示在这个标准温度下所释放的热量。换句话说,当一个可逆机在温度T下吸收热量Q 时,它将在1°下释放热量Q s 。如果一台热机在T 1 下吸收热量Q 1 ,而在1°下放出热量Q s ,并且如果一台热机在T 2 下吸收热量Q 2 ,而在1°下也放出同样的热量Q s ,则一台运行于温度T 1 和T 2 之间的热机将在温度T 1 下吸收热量Q 1 ,而在T 2 下放出热量Q 2 ,这正好和我们考虑在三种温度之间工作的热机时所证明的一样。所以实际上我们所要做的就是求出在温度T 1 时必须给热机多少热量Q 1 才使它在单位温度下放出一定量的Q s 。一旦求得了它,就什么都有了。当然,热量Q 是温度T 的函数。不难看出,当温度增加时,热量也必定增加,因为我们知道使一台热机反过来运行,并把热量释放到温度更高的热库时需要对它做功。也不难看出热量Q 1 必定与Q s 成正比。所以这一条重大的定律可以大致叙述如下:一台在温度T 下运行的热机,在1°下释放出一定的热量Q s ,则热机所吸收的热量Q 必定是Q s 乘以某个温度的递增函数
Q =Q s f (T ).(44.9)
§44-5 热力学温度
现在我们不想利用熟知的水银温标来找出上述温度递增函数的公式,而是要用一个新的温标来定义温度 。在一段时期内,人们曾经将水的膨胀划分为一定大小的均匀标度来任意地定义“温度”。但是后来用水银温度计测量温度时,人们发现这些“度”不再是均匀的了。不过我们现在可以给出一个与任何特殊物质无关的温度的定义 。我们可以利用与所使用的装置无关的函数f (T ),因为这些可逆机的效率与它们的工作物质无关。由于我们找到的这个函数随温度而增加,所以我们将把这个函数本身定义为温度,而以标准的1°作为单位来测定温度,即
Q =ST ,(44.10)
而
Q s =S ·1°.(44.11)
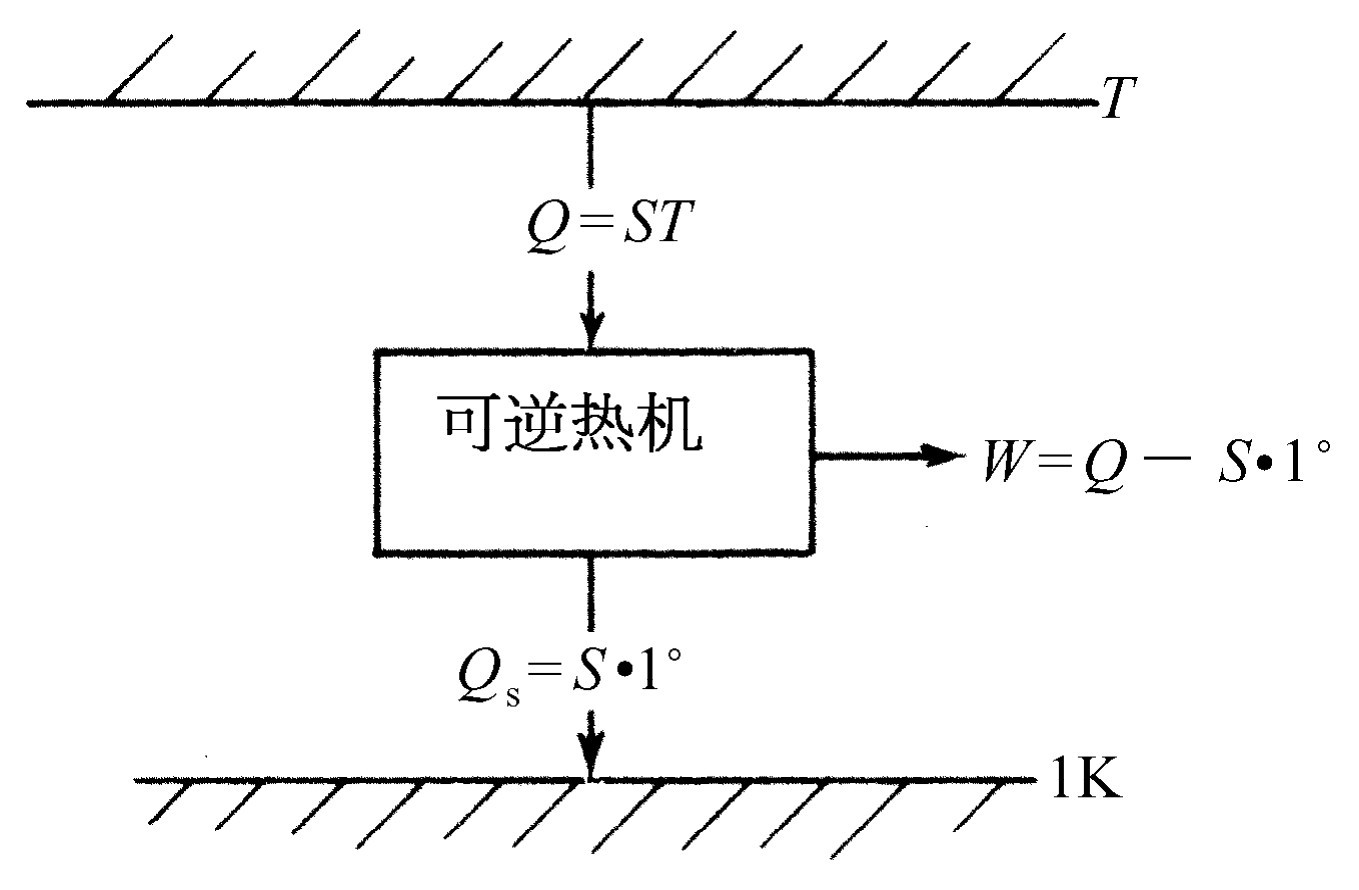
这意味着,如果使一台可逆机运行于某个物体的温度与单位温度之间,只要求出这台可逆机吸收的热量,我们就能说出这个物体有多热(图44-9)。如果从锅炉中吸收的热量是释放到1°的冷凝器中的热量的7倍,锅炉的温度就是7°,等等。所以,通过测量在不同温度下所吸收的热量,我们就能确定温度。以这种方法定义的温度称为热力学绝对温度 ,它和物质无关。以后我们将一概应用这个定义 [1] 。
现在我们看到,如果有两台热机,一台工作于T 1 与1°之间,另一台工作于T 2 与1°之间,它们在单位温度下释放相同的热量,则它们吸收的热量必然满足下列关系
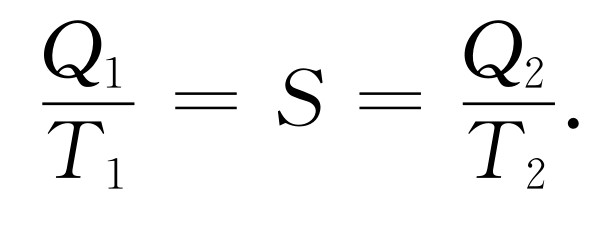 (44.12)
(44.12)
这意味着,如果有某一台运行于T 1 和T 2 之间的热机,那么整个分析所得出的极为重大的结果是:如果热机在温度T 1 吸收热量Q 1 ,并且在温度T 2 放出热量Q 2 ,则Q 1 比T 1 等于Q 2 比T 2 。只要热机是可逆的,这个热量之间的关系就必须满足。全部结果都包括在这里,这是热力学领域的核心。
如果这就是热力学的所有一切,为什么把热力学看成是这样一门困难的学科呢?在处理一个包含一定质量的某种物质的问题时,在任何时刻物质的状态都可以通过给出它的温度和体积来描写。如果我们知道了物质的温度和体积,以及压强是温度与体积的某个函数,则我们就知道内能。有人会说:“我不想这么做,告诉我温度和压强是多少,我就会告诉你体积是多少。我可以把体积看成是温度和压强的函数,把内能看成是温度和压强的函数,等等。”这就是热力学之所以困难的原因,因为每个人都可采用一种不同的途径。只要我们坐下来,决定我们的变量,并且坚持使用下去,那么热力学就会变得非常容易了。
现在我们进行一些推论。正如F =ma 是力学领域的核心,所有一切都不断由它派生,同样的原则也适用于热力学。但人们能由此推出一些什么结论呢?
让我们来开始做这件事情。为了得到第一个推论,我们把能量守恒定律和把Q 2 与Q 1 联系起来的定律结合起来,于是很容易得出可逆机的效率 。由热力学第一定律,我们有W =Q 1 -Q 2 。而按照我们的新原理
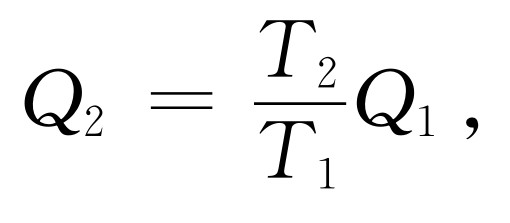
于是功可以写成
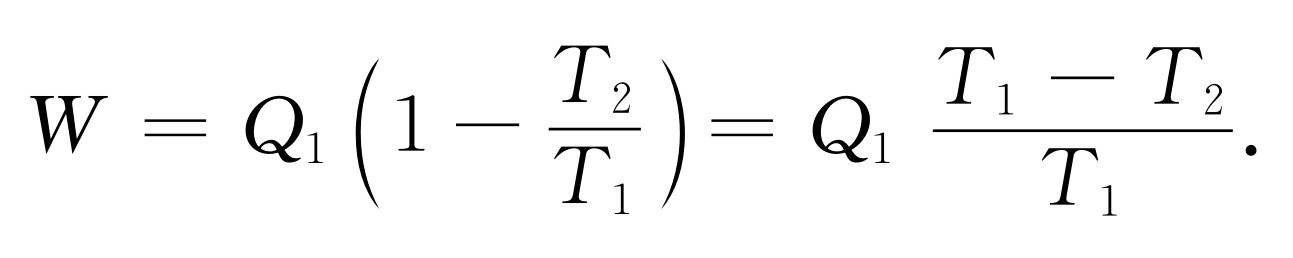 (44.13)
(44.13)
这个公式指出了热机的效率——从那么多的热量中得到了多少功。热机的效率等于热机在其中工作的两个温度之差除以较高的温度
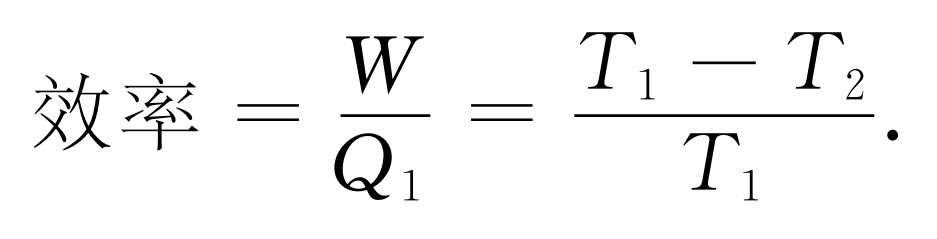 (44.14)
(44.14)
它不可能大于1,因为绝对温度不可能小于绝对零度。这样,由于T 2 必须为正,所以效率总是小于1。这就是我们的第一个推论。
§44-6 熵
式(44.7)或式(44.12)可以按另一种特殊方式来解释。如果工作时都是用可逆机,而Q 1 /T 1 =Q 2 /T 2 ,那么从一个被吸收另一个被释放的意义上来说,温度T 1 的热量Q 1 “等效”于温度T 2 的热量Q 2 。这就启发了我们,如果称Q /T 为某个量,就可以说:在可逆过程中,吸收和放出的Q /T 是一样多;Q /T 既不增加也不减少。这个Q /T 称为熵 。于是我们说:“在可逆循环中,没有熵的净变化。”如果T 是1°,那么熵就是Q /1°,用我们的符号是QS /1°=S 。实际上,S 正是 通常用来表示熵的字母,在数值上它等于释放给1°热库的热量QS (熵本身并不是热量,它等于热量除以温度,因此单位是焦每度 )。
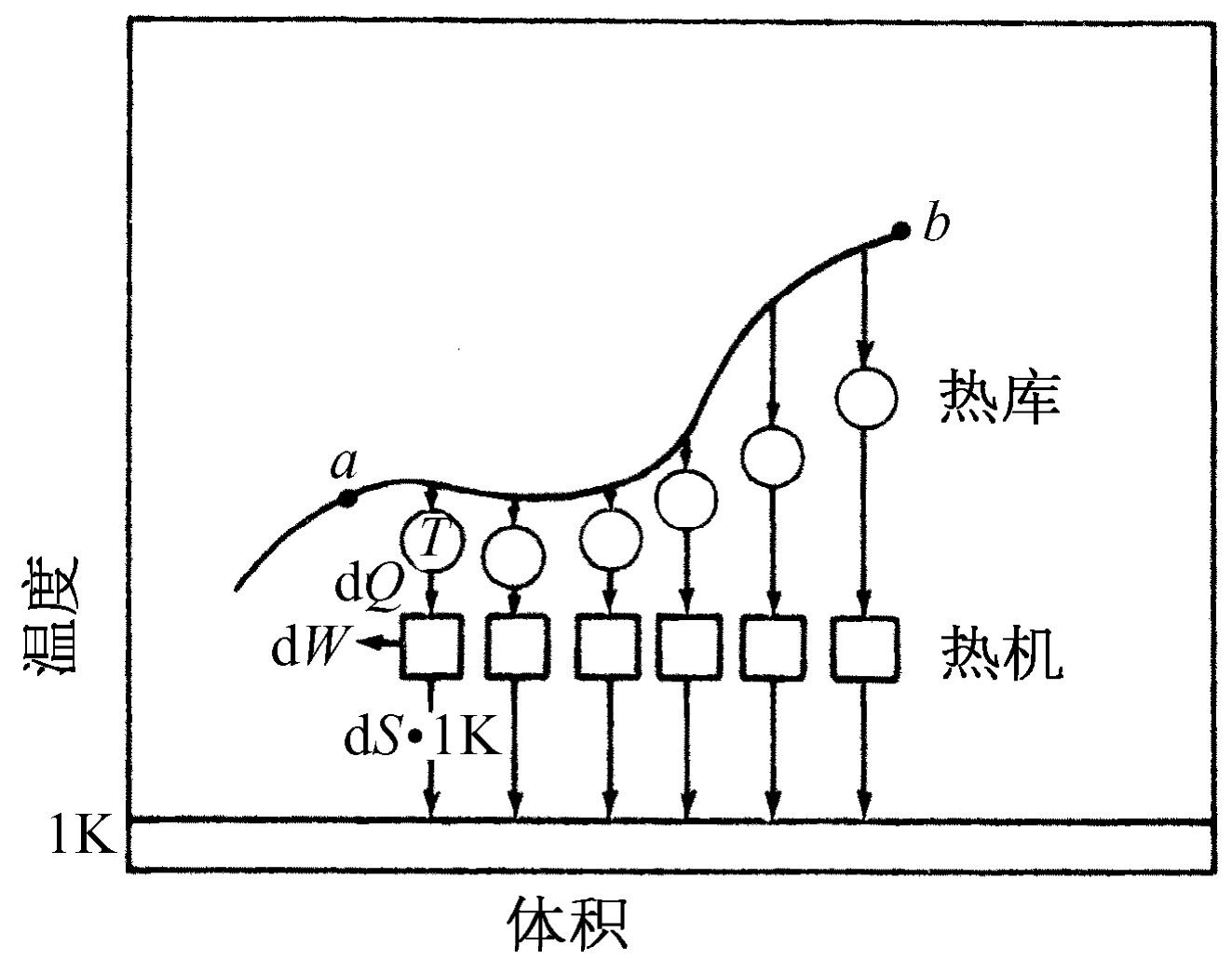
有意思的是,除去压强与内能这两个量是温度与体积的函数外,我们发现另一个量,即物质的熵,也是状态的函数。我们要解释计算它的方法以及把它称为“状态函数”的含义。考虑两个处在不同状态下的系统,它们很像我们在绝热膨胀和等温膨胀的实验中所遇到的情况(附带提一下,热机不一定只有两个热库,它可以从三个或四个不同温度吸热或放热,等等)。我们可以在整个pV 图上到处运动,从一种状态转变到另一种状态。换句话说,我们可以说气体处于某一状态a ,接着转变到另一个状态b ,我们要求从a 至b 的转变是可逆的。现在假设在沿着整条从a 到b 的路径上有许多不同温度的小热库,使得在每一条小路径上由物质放出的热量dQ 都传递给每一对应于路径上该点温度的小热库。然后,我们用可逆热机将所有这些热库联结到单位温度的单个热库上去,当我们完成了物质状态从a 到b 的转变,将使所有热库回到它们的原始状态。在温度T 下从物质中所吸收的任何热量dQ 都被可逆机变换了,而且把一定量的熵传递给单位温度,即
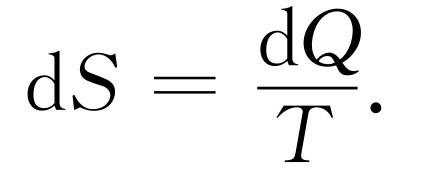 (44.15)
(44.15)
我们来计算所传递的总熵。熵的差值,或者说在这个特殊的从a 到b 的可逆变化中所需要的熵,就是从小热库中所得到并传递给单位温度的熵的总和
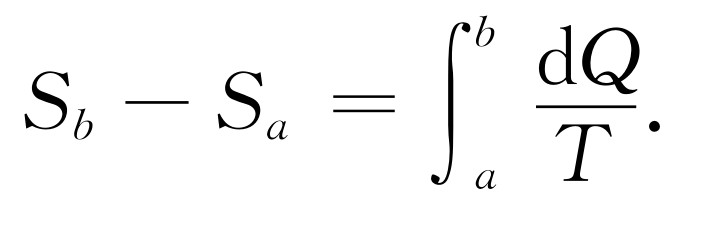 (44.16)
(44.16)
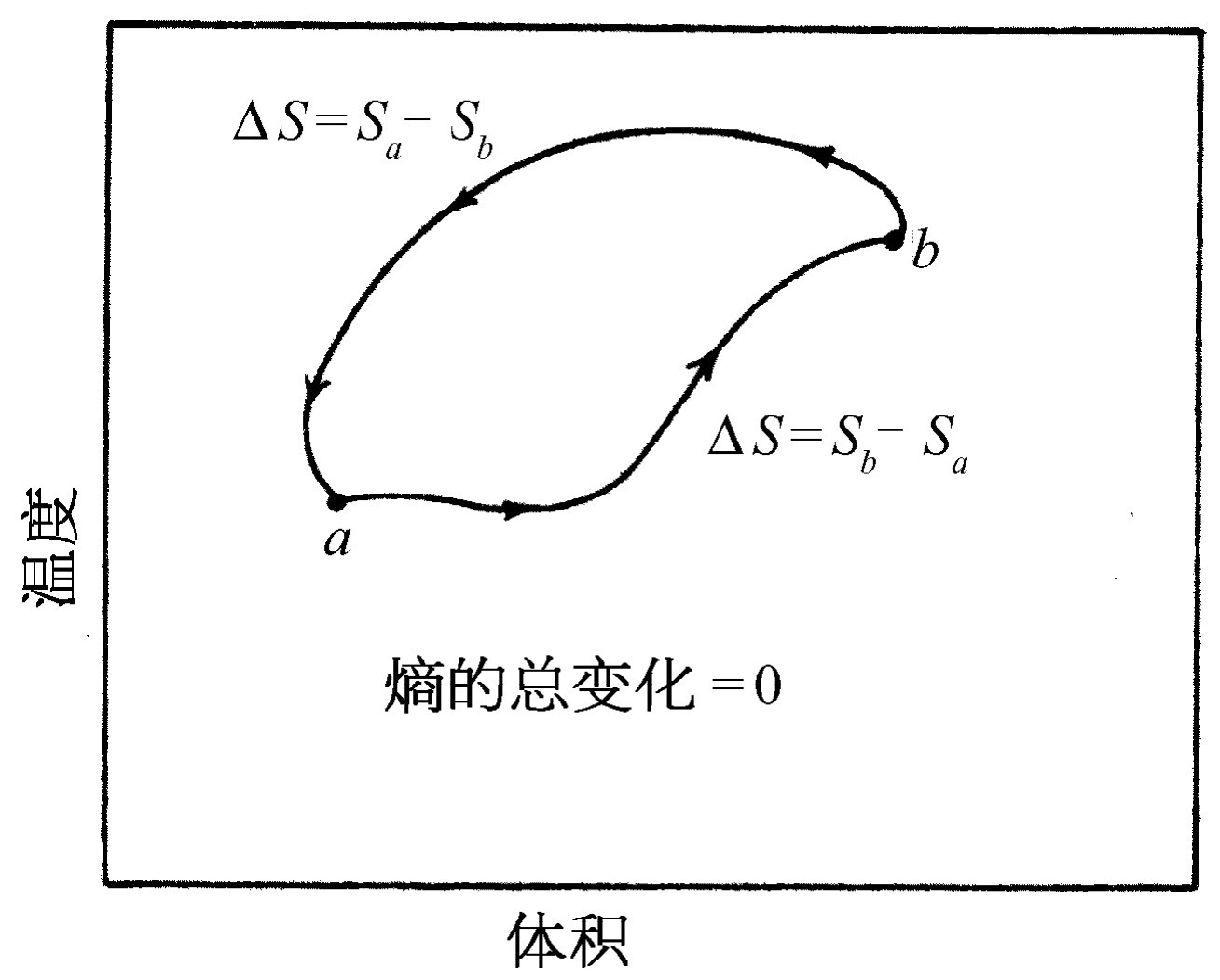
问题在于熵的差值是否与所选路径有关?从a 至b 不止有一条路径。我们记得在卡诺循环中,从图44-6中的a 到c 可以先等温膨胀,然后再绝热膨胀,也可以先绝热膨胀,然后再等温膨胀。所以问题是,当我们从图44-10的a 到b 时,沿一条路径的熵的变化是否与沿另一条路径相同?答案是它们必须相等。因为如果我们沿着这个循环走过所有路径,向前走的时候沿着一条路径,回来的时候沿着另一条路径,这就相当于一台可逆机,并且对于单位温度的热库来说,没有什么热量损失。在整个可逆循环中不必从单位温度的热库取出热量,所以经过从a 到b 的一条路径与经过另一条路径所需的熵相同,它与路径无关 ,只取决于端点。因此我们可以说,存在着称为物质的熵的某个确定的函数,它取决于物质的状态,即只取决于体积和温度。
我们可以找出一个函数S (V ,T ),它具有这样的性质,当我们根据单位温度释放出的热量来计算物质沿任何一条可逆路径熵的变化时,有
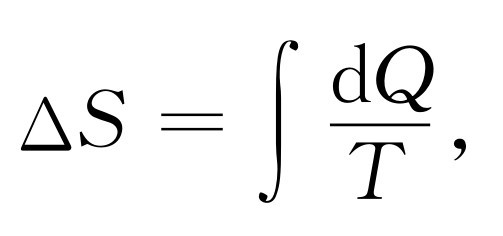 (44.17)
(44.17)
这里dQ 是从温度为T 的物质取走的热量。这个总的熵的改变是在起点和终点计算的熵的差值
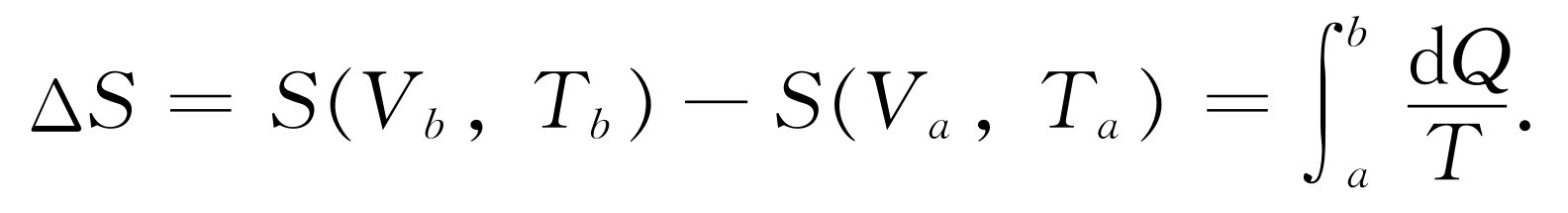 (44.18)
(44.18)
这个表示式并没有完全确定熵函数,而只是决定了两个不同状态之间的熵的差 。只有当我们能够计算一种特殊状态下的熵以后,才可以真正确定S 的绝对值。
长期以来人们相信,绝对熵毫无意义——只有它们的差才可以定义——但是最后能斯特(Nernst)提出他的所谓热定理 ,也叫做热力学第三定律。这是一条非常简单的定律,我们将讲一下它是什么,而不去解释它为什么是对的。能斯特的假设简单说来就是:在绝对零度时任何物质的熵为零。于是我们就知道一种T 和V 的情况,即T =0时S 值为零。因而我们可以得到其他任何点的熵。
为了说明这些概念,我们来计算理想气体的熵。在等温可逆膨胀中,∫dQ /T 是Q /T ,因为T 是常数。所以由式(44.4),可得出熵的变化为
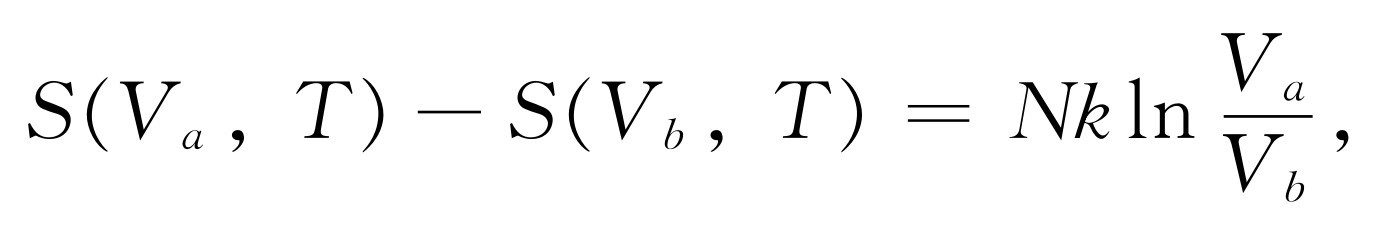
因此S (V ,T )等于Nk lnV 加上某个仅是T 的函数。S 和T 的依赖关系如何?我们知道,在可逆绝热膨胀中不交换热量 。所以即使V 发生变化,熵也不发生变化,因为假设T 也随着变化,以致有TV γ -1 =常数。读者能否看出这意味着
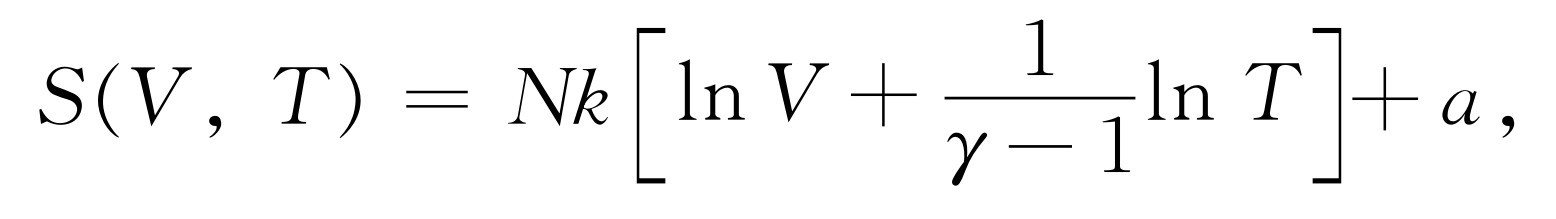
这里a 是与V ,T 两者 都无关的某个常数[a 称为化学常数,它取决于所考虑的气体,可以按能斯特定理从实验上通过测量气体冷却到0°并凝结为固体(对氦是液体)时所释放的热量,再由积分∫dQ /T 来确定。也可以从理论上用普朗克常数与量子力学来确定,但在这个课程中我们不准备进行讨论]。
现在我们要对物质的熵的某些性质作些说明。首先我们记得,如果沿着一条可逆循环路径从a 到b 运动,那么物质的熵将改变(S b -S a )。我们也记得,如果沿着这条路径运动,熵——在单位温度释放的热量——将按照dS =dQ /T 的规则增加,这里dQ 是从温度为T 的物质中取走的热量。
我们已经知道,如果一个循环 可逆,则一切事物的总熵就不会改变,因为在T 1 吸收的热量Q 1 与在T 2 放出的热量Q 2 对应着相等和相反符号的熵的变化,所以熵的净变化为零。所以对于可逆循环,包括热库在内的一切事物的熵没有变化(图44-11)。这条规则看起来似乎像能量守恒,但其实不然,它只适用于可逆循环。如果包括不可逆循环,就不存在熵的守恒定律。
举两个例子来说明。首先,假设我们通过摩擦对一个物体做了不可逆功,在某个温度T 下的物体产生了热量Q ,则熵增加了Q /T 。热量Q 等于所做的功,所以当我们通过摩擦对温度为T 的物体做了一定的功时,整个系统的熵增加了W /T 。
再举一个不可逆的例子:如果我们把两个不同温度T 1 和T 2 的物体放在一起,那么一定量的热量将自动地从一个物体流到另一个物体。比方说,假如将一块很热的石头放到冷水中去,当从T 1 到T 2 传递了一定的热量ΔQ 后,热的石头的熵的改变有多大?它减少了ΔQ /T 1 。水的熵的改变又是多少?它增加了ΔQ /T 2 。当然,热量只能从较高的温度T 1 流向较低的温度T 2 ,如果T 1 大于T 2 ,ΔQ 为正。所以整个系统的熵的改变为正,它是这样两个分数之差
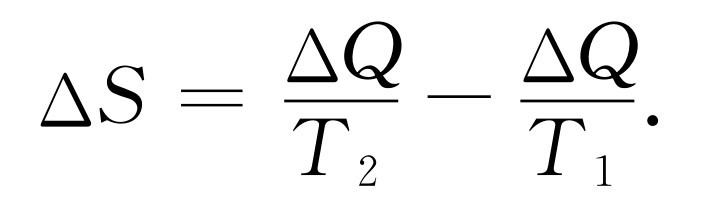 (44.19)
(44.19)
因此,下述命题成立:在任何不可逆过程中,整个系统的熵将增加。只有在可逆过程中熵才保持不变。由于没有什么过程是绝对可逆的,熵至少总有一点增加;一个可逆过程是一种使熵的增加最小的理想化过程。
遗憾的是,我们不打算深入到热力学领域中去。我们的目的只在于说明所涉及的原则性概念,以及为什么能作这些论证的理由,而不想在这门课程中使热力学用得太多。工程师,特别是化学家常常要用到热力学。所以我们必须在化学或工程的实践中学习热力学。因为不值得对每件事情都花双倍的精力,所以我们只对热力学理论的起源作一些讨论,而不详细研究它的特殊应用。
人们常将两条热力学定律表述为:
第一定律 :宇宙的能量始终保持不变;
第二定律 :宇宙的熵值始终不断增加。
这不是第二定律的最好的表述;例如,它没有说明在可逆循环中熵值保持相同,也没有精确说明熵是什么。这只是便于记忆这两条定律的很好的办法,但是实际上它没有告诉我们真正的立足点。在表44-1中,我们概括一下本章所讨论的定律。下一章我们将运用这些定律来找出在橡皮带膨胀时所产生的热量与加热带子时的附加张力之间的关系。
表44-1 热力学定律总结